Skriv ut
Utredning ved brystkreft
Hvis det foreligger mistanke om brystkreft vil dette utredes videre med en kombinasjon av tre ulike underøkelser kalt trippeldiagnostikk. Dette innebærer klinisk undersøkelse, mammografi/bildediagnostikk og vevsprøve (biopsi).
Klinisk undersøkelse
Legen gjør en systematisk inspeksjon og palpasjon av bryst og armhule. Det blir sjekket for eventuelle hudforandringer og forandringer på brystvorten. Disse observasjonene gjøres som grunnlag for videre utredning. Svulster registreres med lokalisasjon, størrelse i millimeter, konsistens og bevegelighet i forhold til omliggende strukturer og vev.
Bildediagnostikk
Mammografi gjøres hos kvinner som har symptomer eller funn i brystet. Mammografi benyttes også som screeningundersøkelse for å påvise brystkreft på et tidlig stadium.
Det norske Mammografiprogrammet ble landsdekkende fra februar 2004. Programmet er en systematisk og organisert undersøkelse som tilbyr kvinner i alderen 50–69 år mammografi av hvert bryst hvert annet år.
Les mer om mammografi >>>
Spesielle forhold knyttet til mammografiscreening
- Kvinner med innlagt silikonprotese(r) blir innkalt selv om diagnostikken er mindre sikker ved proteser.
- Kvinner som er gravide kan ta mammografi da dette ikke utgjør noen fare for fosteret.
- Kvinner med arvelig brystkreftrisiko har rett til årlig klinisk mammografi fram til fylte 60 år etter nasjonale retningslinjer. Avdeling for medisinsk genetikk tar i mot direkte henvendelser, og vil kunne avgjøre om kvinnen har rett til årlig oppfølging.
- Kvinner operert for brystkreft kontrolleres i 10 år etter nasjonale retningslinjer. Har pasienten fjernet brystet etter fylte 50 år deltar i Mammografiprogrammet og i tillegg henvises til klinisk mammografi hvert annet år. Etter 10 år skal alle over 50 år tilbys deltagelse i Mammografiprogrammet på lik linje med kvinner som ikke har hatt brystkreft. For pasienter som etter 10 år ikke har nådd screeningalder, er det aktuelt å fortsette med klinisk mammografi frem til de kan delta i Mammografiprogrammet.
- Ultralyd inngår ikke rutinemessig som en del av Mammografiprogrammet, selv ikke hos kvinner med innsatte proteser.
Mammografi kan være smertefullt, og noen ønsker derfor kun å gjøre ultralyd Det er da viktig å være oppmerksom på at ultralyd alene ikke er god nok diagnostikk for å utelukke brystkreft. Det kan derimot være aktuelt å ta ultralydundersøkelse og Magnettomografi (MR) som tilleggsundersøkelser.
Nåleprøve-/vevsprøve
For å kunne avkrefte/bekrefte en kreftdiagnose må det tas vevsprøver av svulsten i brystet. Vevsprøvetakingen foregår under veiledning av ultralyd eller røntgen slik at man er sikker på at vevsprøven tas fra rett sted. Undersøkelsen foregår ved at en nål stikkes gjennom huden til det aktuelle området som det ønskes biopsi av.
- FNAC- Ved stor sannsynlighet for at kulen er godartet eller ved behov for raskt svar på om kulen er ondartet, brukes FNAC. Det stikkes da en tynn nål inn i svulsten og suges ut celler som undersøkes i mikroskop. Undersøkelsen foregår under veiledning av ultralyd.
- Grovnålsbiopsi (sylinderbiopsi). Her brukes det en litt tykkere nål og det tas ut flere små vevssylindere fra svulsten. Vevsprøven sendes til histologisk vurdering. Undersøkelsen foregår under veiledning av røntgen.
Celle- og vevsprøver sendes til cytologisk/histologisk analyse. Analysene kan være avgjørende for hvilken behandling som er aktuell.
Arvelig brystkreft
Kriterier for henvisning til utredning for arvelig kreft:
- Påvist genfeil hos brystkreftpasient
- Opphopning av kreft i slekten
- To søstre eller mor-datter med brystkreft før 50 år
- Flere tilfeller av brystkreft i slekten
- Både bryst- og eggstokkreft i slekten
En bør være oppmerksom på bryst- og eggstokkreft også der slektskapet går gjennom menn.
Alle kvinner som er i en risikogruppe for arvelig brystkreft skal ha tilbud om spesiell oppfølging i form av radiologiske kontroller.
Friske kvinner som får påvist genfeil eller med spesielt stor familiebelastning av brystkreft vil få spesiell oppfølgning
Kvinner med påvist risiko for arvelig brystkreft ut fra familiehistorie (ikke påvist genfeil) bør screenes årlig fra 30-års alder. Fra fylte 60 år kan de følge det norske Mammografiprogrammet med screening hvert annet år. Ved påvist genfeil anbefales MR fra 25 års alderen. Det bør i tillegg til MR utføres mammografi. Ultralyd utføres dersom det foreligger uavklarte MR funn.
Bildeeksempler
Forstadier til brystkreft (carcinoma in situ)
Forstadiet til brystkreft kjennetegnes ved at man gjennom mikroskop ser tegn på unormal celledeling enten i melkeganger (duktalt) eller i kjertlenes endestykker (lobulært), men at det ikke er tegn til at kjertlenes epitelceller har brutt gjennom den hinnen de er festet til (basalmembranen). Hvis cellene har greid å trenge igjennom basalmembranen, og blitt invasiv, er det et infiltrerende karsinom, og behandlingen skal være deretter.
Normalt har kjertelen to cellelag. Tre eller flere cellelag er uttrykk for unormal celledeling og forstadium til kreft.
Avhengig av graden av celledeling, cellenes avvikende utseende og egenskaper (atypi) og vevsarkitektur kan en inndele brystkreft i fire typer:
- Lobulær og duktal epitelhyperplasi uten atypi – Økt celledeling i epitellaget av kjertelendestykke eller gangsystemet, men uten uregelmessige celler
- Lobulær og duktal epitelhyperplasi med atypi – Økt celledeling i epitellaget av kjertelendestykke eller gangsystemet, med uregelmessige celler
- Lobulært carcinoma in situ (LCIS) – Tidlig stadium av svulstdannelse i kjertlenes endestykker
- Duktalt carcinoma in situ (DCIS) grad 1-3 (van Nuys gradering) - Tidlig stadium av svulstdannelse i melkegangene
Det er en glidende overgang mellom de forskjellige typene, noe som gjør at en må regne med variasjon i de histologiske diagnoser.
Sylindercellelesjoner og Flat epitelial atypi (FEA)
Interessen for disse entitetene har økt fordi de ses hyppigere i screeningprøver. Lesjoner med sylinderepitelkledning i terminale ductolobulære enheter kan deles inn i 3 entiteter:
- sylindercelleforandringer (columnar cell change)
- sylindercellehyperplasi (columnar cell hyperplasia)
- flat epitelial atypi
Sylindercelleforandringer og sylindercellehyperplasi (Columnar cell change (CCC) og columnar cell hyperplasia (CCH))
Lesjoner med forstørrede ductolobulære enheter kledt med sylinderepitel uten atypi med henholdsvis 1-2 lag sylinderepitel (CCC) eller > 2 cellelag (CCH). (Disse entitetene beskrives med ulike navn i litteraturen som for eksempel columnar metaplasia og blunt duct adenosis)
Flat epitelial atypi (FEA)
Lesjoner med forstørrede terminale ductolobulære enheter med ett eller flere lag kubisk eller sylindrisk epitel som viser lavgradig cytologisk atypi. (Denne entiteten blir i litteraturen også kalt clinging carcinoma (monomorphic type), atypical columnar cell lesion, columnar cell change with atypia, columnar cell hyperplasia with atypia).
Det foreligger svært lav risiko for residiv eller progresjon til kreft når disse opptrer som isolerte lesjoner, men siden FEA oftest ses sammen med andre lesjoner er det vanskelig å si noe om prognose, men WHO working group (2011) mener at FEA utgjør lavere risiko for kreft enn ADH og ALH.
Ved funn av FEA i nålebiopsi bør men skjære dypere snitt for å lete etter assosierte lesjoner. Behovet for å rutinemessig fjerne lesjoner med FEA er usikkert. WHO Working Group 2011 anbefaler at man vurderer hvert enkelt tilfelle og eventuelt tar en merkebiopsi for å utelukke mer avansert lesjon.
Tidlig stadium av ondartet svulstdannelse i kjertlenes endestykker (Lobulært carcinoma in situ, LCIS)
LCIS er kjennetegnet ved at kjertelendestykkene er helt overfylt av epitelceller som ikke går gjennom basalmembranen. Tilstanden oppdages som regel tilfeldig i en biopsi gjort for en tumor som kjennes gjennom huden, som er av en annen histologisk type, eller i forbindelse med en infiltrerende svulst (karsinom) i kjertelendestykkene.
Den absolutte risiko for utvikling av infiltrerende karsinom hos en pasient som har blitt behandlet for LCIS er cirka 10% etter 10 år, 20% etter 20 år, og ved livstidsobservasjon henimot 30%. Det infiltrerende karsinomet hos pasienter med LCIS er oftest av duktal type, altså i melkegangsystemet. Risikoen for utvikling av infiltrerende karsinom er like stor i det andre brystet som i det biopserte brystet.
Tidlig stadium av ondartet svulstdannelse i gangsystemet (Duktalt carcinoma in situ, DCIS)
DCIS, også betegnet intraduktalt karsinom, må ikke forveksles med invasivt karsinom av duktal type. DCIS er et tidlig stadium av celleforandring som ikke har gått gjennom basalmembranen.
Tidligere ble DCIS en sjelden oppdaget og utgjorde kun mellom 1,4 og 5,3 % av alle nydiagnostiserte brystkrefttilfeller. Etter hvert som mammografi er blitt mer utbredt, påvises mistanke om slike forandringer hyppigere (mellom 5–10 %). I områder med etablert mammografiscreening utgjør DCIS 25–30 % av de nye brystkrefttilfellene i første screeningrunde. I senere screeningrunder vil andelen være 10–20 %.
Hovedproblemet med DCIS er at risikoen for at en liten del av svulsten blir igjen i brystet etter fjerning (residiv) er betydelig større enn ved fjerning av andre typer celleforandringer i brystkjertelvevet.
Risiko for residiv avhenger av flere faktorer, og er større for:
- DCIS svulster som kan kjennes gjennom huden
- DCIS grad 3 enn for DCIS grad 1 og 2
- diffust utbredt enn for avgrensede
- yngre kvinner
De fleste residiv befinner seg nært det primære arret. Den primære mammabiopsi må derfor ha histologisk fri margin, hvilket betyr at kirurgen må skjære vekk ekstra vev rundt svulsten der det er sannsynlig at celleforandinger kan befinne seg. NBCG anbefaler minimum 5 mm.
Kreftsvulster som vokser gjennom vevet rundt (Invasive karsinomer)
70–80% av brystkjertelens invasive kreftsvulster er histologisk av infiltrerende duktal type, altså med utgangspunkt i kjertelgangene med gjennomvekst til vevet rundt. 10–20 % er av infiltrerende lobulær type, mens ulike andre typer utgjør resten. Noen av disse har bedre prognose enn gjennomsnittet, for eksempel tubulært (rørformet) karsinom, medullært karsinom, mucinøst (slimet) karsinom og adenoid (kjertelliknende) cystisk karsinom. Andre typer med dårligere prognoser er papillært, sekretorisk og apokrint karsinom. Pagets sykdom i papillen er nesten alltid forbundet med et underliggende duktalt karsinom.
Patologgruppen i Norsk Bryst Cancer Gruppe (NBCG) har distribuert veldefinerte kriterier for histologisk vurdering av brystkreftsvulster til alle landets patologilaboratorier. Alle invasive karsinomer skal graderes etter de samme kriteriene. Eventuelle østrogen- og progesteronreseptor skal analyseres på alle invasive karsinomer. I tillegg skal det utføres Her2 -undersøkelse (ved hjelp av immunhistokjemi og/eller FISH/CISH).
Undersøkelsen bør inneholde informasjon om:
- tumors beliggenhet, størrelse/diameter (mm) og utbredelse (eventuelt om det er flere tumorer, eller flere utgangspunkter i samme tumor)
- histologisk type
- histologisk gradering
- utbredelse, beliggenhet og grad av DCIS i et invasivt karsinom
- tumors avstand til skjærekantene etter kirurgi (angitt i mm), eventuelt til hud og til brystvegg
- antall lymfeknuter med metastaser og totalt antall undersøkte lymfeknuter
- størrelse på den største påviste lymfeknutemetastase
- tumorinfiltrasjon i forbindelse med lymfeknute, inkludert beskrivelse av om den er makroskopisk eller kun mikroskopisk, og beskrivelse av eventuell grupper ("øyer") av tumorceller i fettvev
- hormonreseptoranalyse basert på immunhistokjemi eller immunocytologi
- Her2-status
Det gjøres immunhistokjemi for å avgjøre Her2-amplifikasjon i tumor. Resultatet graderes fra 0–3+, hvor 0 og 1+ er klart negativ og 3 er klinisk positiv. Ved score 2+ gjøres i tillegg en FISH-test for å fastslå Her2-amplifikasjon.
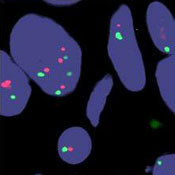 |
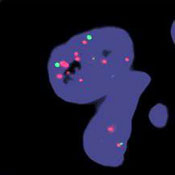 |
Negativ FISH
|
Positiv FISH
|
FISH-test for å bestemme Her2-amplifikasjon:
- Likevekt mellom røde og grønne prikker (bilde til venstre) tilsier ingen Her2-amplifikasjon (negativ FISH).
- Overvekt av røde prikker (bilde til høyre) tilsier Her2-amplifikasjon i tumor (positiv FISH).
Les om ulike typer celleforandringer